QUEILITE ACTÍNICA CRÔNICA ESTUDO E CORRELAÇÕES DOS ASPECTOS CLÍNICOS E HISTOPATOLÓGICOS
FRANCISCO OCTÁVIO TEIXEIRA PACCA*
GILBERTO MARCUCCI**
FÁBIO DAUMAS***
CARLOS EDUARDO XAVIER DOS SANTOS RIBEIRO DA SILVA****
RODRIGO ALARCON CERRI*****
ARTUR CERRI******
* Mestre e Doutor em Semiologia pela FOUSP, Professor Doutor Colaborador da Universidade de Santo Amaro (UNISA).
** Professor Titular da Disciplina de Semiologia da FOUSP.
*** Professor Livre Docente e Associado da Disciplina de Patologia Bucal da FOUSP.
**** Doutor em Estomatologia pela UNIFESP, Professor Doutor da Disciplina de Estomatologia da UNISA.
***** Especialista em Estomatologia pela UNISA, Estomatologista do Hospital Geral de São Paulo (HGeSP).
****** Mestre e Doutor em Semiologia pela FOUSP, Professor Doutor da Disciplina de Estomatologia da UNISA
Autor Correspondente:
FRANCISCO OCTÁVIO TEIXEIRA PACCA
Rua Pelotas, 358 – Vila Mariana – São Paulo – CEP 04012-010
Área de enfoque: ESTOMATOLOGIA
Categoria do artigo: Artigo Original
QUEILITE ACTÍNICA CRÔNICA
ESTUDO E CORRELAÇÕES DOS ASPECTOS CLÍNICOS E HISTOPATOLÓGICOS
RESUMO
A Queilite Actínica Crônica (QAC) é uma lesão labial considerada uma das principais lesões cancerizáveis da boca, em nosso estudo foram avaliados 29 pacientes portadores de QAC, observando e relacionando a epidemiologia da doença, os aspectos clínicos e histológicos bem como os respectivos graus de atipia celular. A QAC ocorreu em 100% nos indivíduos da raça branca, em 19 homens (65,51%) e 10 mulheres (34,49) e na idade média de 56,14 anos. Foram avaliados também os aspectos clínicos e histológicos da QAC sendo encontrados 14 casos de atipia epitelial discreta (48,27%), 10 casos de atipia epitelial moderada (34,49%) e 5 casos de atipia epitelial severa (17,24%). Através de análise estatística concluímos que clinicamente a presença de áreas leucoplasicas e o tempo de evolução da lesão superior a 5 anos estão diretamente relacionados aos casos de atipias epiteliais mais graves. O hábito de fumar e de beber parecem contribuir mas não obtiveram resultados estatisticamente significativos ao aparecimento da QAC.
Palavras-chave: queilite – boca
Keywords: Cheilitis – Mouth
CHRONIC ACTINIC CHEILITS
STUDY AND CORRELATIONS BETWEEN CLINICAL ASPECTS AND HISTOPATOLOGICAL FINDINGS
ABSTRACT
The Chronic Actinic Cheilitis (CAC) is a labial injury considered one of the main precancerous injuries of the mouth. Our study had been evaluated 29 carrying patients of CAC, observing and relating the epidemiology of the illness, clinical and histological aspects as well as the respective degrees of cellular atipia. The CAC occurred in 100% in the individuals of the white race, in 19 men (65.51%) and 10 women (34,49 %) and in the average age of 56,14 years. The clinical and histological aspects of the CAC found had been evaluated also. We found 14 cases of discrete epithelial atipia (48.27%), 10 cases of moderate epithelial atipia (34.49%) and 5 cases of severe epithelial atipia (17.24%). Through statistical analysis we concluded that the presence of leucoplasics areas and evolution time superior of 5 years are directly related to the cases of more dangerous epithelial atipias. The habit to smoke and drink seems to contribute but they had not gotten statistical significance to the appearance of the CAC.
1 INTRODUÇÃO
A etimologia da palavra queilite deriva do grego “keilos”, que significa lábios e são consideradas lesões actínicas, aquelas decorrentes da radiação actínica, que é um grupo da radiação ultra-violeta que oscila entre 2300 a 3200 A 1.
A Queilite Actínica Crônica é uma lesão de extrema importância por se tratar de uma lesão cancerizável2,3,4 .
Clinicamente, a QAC ocorre predominantemente em indivíduos acima de quarenta anos, leucodermas, do sexo masculino e que se expõe continuamente aos raios solares, como agricultores, marinheiros, pescadores, guardadores de carro, operários de construção e outros. A sua localização mais freqüente é o lábio inferior, pois este está anatomicamente mais exposto à ação maléfica dos raios solares5 . Clinicamente o lábio com QAC pode apresentar as seguintes alterações: descamações, ressecamento, fissuras, adelgaçamento do vermelhão, eritemas, edema, áreas esbranquiçadas, falta dos limites na linha de transição entre vermelhão e pele, crostas, perda da elasticidade, ulcerações e sangramento6 . A radiação solar é o agente etiológico da QAC e do câncer de lábio, muito embora se saiba que a probabilidade de malignização pode ser mais elevada, quando associada a outros fatores carcinogênicos, entre os quais o álcool e o fumo, nas suas mais variadas formas7,8.
2 REVISÃO DA LITERATURA
A queilite actínica crônica foi descrita e considerada como uma lesão cancerizável pela primeira vez, em 1886 por Dubrevil, durante o III Congresso Internacional de Dermatologia, realizado em Londres9 . Posteriormente, Ayres Jr. (1923), relacionou a etiologia da QAC com a exposição solar. Neste trabalho, foram examinados cinco pacientes provenientes de regiões quentes e secas da Califórnia e que desenvolviam atividades sob o sol constante, foram observadas as características clínicas das lesões bem como a prevenção de possível malignização10.
Como já comentado na introdução, Dufresne Jr. e Curlin (1997), descreveram as possíveis alterações clínicas para a QAC: edema, eritema, ressecamento, fissuras, descamações, falta de evidências dos limites entre vermelhão e pele, ulcerações, sangramentos, áreas leucoplásicas, crostas, adelgaçamento de vermelhão e perda da elasticidade labial6. Neste mesmo trabalho, Dufresne Jr. e Curlin (1997), estudaram os estágios clínicos da QAC descrevendo o eritema e o edema como as primeiras manifestações, enquanto nos estágios mais avançados foram observadas a presença de áreas leucoplásicas e as ulcerações6. A QAC pode apresentar as seguintes alterações histológicas: polaridade, nuclear alterada, relação núcleo citoplasma aumentada, hiperplasia das células basais, núcleos hipercromáticos, mitoses anormais, ortoqueratose, paraqueratose, maturação epitelial alterada, coesão celular reduzida, degeneração do colágeno (elastose), infiltrado inflamatório, ulceração, vasodilatação, acantose, e atrofia epitelial11 .
2.2 QAC e o câncer de lábio
O primeiro trabalho científico a relacionar o aspecto clínico com o quadro histológico da QAC e do câncer de lábio foi realizado por Nicolau e Ballus (1964). Os autores estudaram 542 pacientes com QAC e 76 pacientes com câncer de lábio, chegando a conclusão que a imensa maioria dos cânceres de lábio, é precedida de queilite actínica crônica12; daí a classificação proposta por Cataldo e Doku (1981), como sendo a QAC uma lesão com alto potencial de transformação maligna13. Alguns trabalhos na literatura tentam quantificar o percentual de malignização da QAC para o CEC de lábio, estes resultados variam de 12% a 20%9,14,15,16 .De qualquer forma o percentual é preocupante e coloca o diagnóstico precoce como fundamental. Huber e Terezhalmy (2006) descrevem que o potencial de malignação pode inclusive ultrapassar os 20% e enfatiza a importância de biopsiar todos os casos de QAC16. Outra característica do CEC de lábio é que seu aparecimento acomete principalmente indivíduos leucodermas acima da quinta década de vida submetidos a fatores desencadeantes8.
A radiação solar é considerada o principal fator desencadeante do CEC de lábio inferior. Os danos induzidos pela radiação ultravioleta B (UVB) se devem a sua intensa absorção pelos ácidos nucleicos. A maior parte dos danos é causada por alterações que impedem a transcrição da informação genética para o ácido ribonucleico mensageiro (RNA m) e bloqueiam o mecanismo de duplicação do ácido desoxirribonucleico (DNA). De forma bastante simplificada, as reações fotoquímicas que alteram o DNA podem ocorrer na estrutura primária dos nucleotídeos ou no rompimento de hélices e pontes de hidrogênio. Estas alterações comumente provocam a geração de produtos que podem bloquear, ainda que parcialmente, as enzimas de separação dos ácidos nucleicos 17.
Outros agentes desencadeantes do câncer de lábio inferior são citados na literatura há bastante tempo, dentre eles o tabaco e o álcool8. No tabaco e na fumaça que deles se desprende, podem ser identificadas cerca de 4.700 substâncias tóxicas. Dentre estas, 60 apresentam ação carcinogênica conhecida, destacando-se os hidrocarbonetos policíclicos e as nitrosaminas específicas do tabaco. Outras substâncias carcinogênicas também são detectadas no tabaco e na sua fumaça, dentre elas, elementos radioativos como o carbono 14 e o polônio 210, como também resíduos de agrotóxicos utilizados na lavoura do tabaco como o diclorodifeniltricloretano (DDT) e outros18 .
Além da ação maléfica das substâncias cancerígenas, a exposição contínua ao calor desprendido pela combustão do fumo potencializa as agressões sobre a mucosa e semimucosa, pois sabemos que a temperatura na ponta do cigarro varia de 835 a 884ºC19. Sabe-se que o álcool se apresenta como agente promotor do câncer, interferindo principalmente na velocidade e na quantidade de reparação dos defeitos do DNA, induzidos pelos carcinógenos verdadeiros como o tabaco e a radiação.
O álcool pode agir no desenvolvimento do câncer das seguintes formas:
– Aumento de permeabilidade das células da mucosa e semimucosa aos agentes carcinogênicos, devido ao efeito solubilizante do álcool.
– Agressão celular produzida pelos metabólitos do etanol, os chamados aldeídos.
– Deficiências nutricionais secundárias ao consumo crônico do próprio álcool.
– Diminuição dos mecanismos locais de defesa.
Segundo o manual de “Detecção de lesões suspeitas de câncer de boca”, Instituto Nacional do Câncer (INCA), quando o alcoolismo e o tabagismo se associam, o risco relativo de câncer bucal é potencializado drasticamente, sendo 141,6 vezes maior do que em pacientes que não fumam e não bebem18. Outro importante fator a ser considerado ao aparecimento do câncer, são as deficiências nutricionais e dietas inadequadas, ricas em fontes formadoras de radicais livres, pois estes também são responsáveis por alterações no DNA. Sabe-se hoje que uma alimentação rica em proteínas A, E, C e B2 e alguns minerais como o cálcio, zinco e selênio, são considerados antagonistas de radicais livres, chamados de antioxidantes20. Para Lindqvist, Teppo e Pukkala (1981), a dieta nutricional pobre em betacaroteno (precursor da vitamina A) associada à exposição solar e ao fumo, também representa um importante fator a ser considerado21. Garewal (1993) verificou um baixo risco de desenvolvimento de câncer de boca entre indivíduos que consumiam altos índices de frutas cítricas e vegetais ricos em beta-caroteno22. Por estes motivos, é incentivado cada vez mais o hábito do consumo de frutas e vegetais23.
3 PROPOSIÇÃO
A proposta de nosso estudo foi avaliar os aspectos clínicos, histológicos e epidemiológicos da QAC .
4 MATERIAL E MÉTODO
Foram selecionados para o presente estudo 29 pacientes portadores de QAC e um grupo controle de 29 pacientes sem nenhuma evidência de lesão labial inferior que foi selecionado fazendo-se o pareamento de raça, gênero e idade com o grupo doente
4.1 Avaliação clínica
Todos os pacientes foram submetidos a exame clínico completo e ordenado, composto por anamnese, exame físico extra e intra-bucal. O exame clínico e o atendimento dos pacientes foram realizados na clínica de Semiologia da FOUSP.
4.2 Critérios adotados para a interpretação da ficha clínica
Foram considerados fumantes os indivíduos que fumam ou que fumaram regularmente durante alguma época da vida (pelo menos por cinco anos), mesmo aqueles que abandonaram o vício de fumar e foram considerados etilistas os indivíduos que bebem ou que beberam (diariamente) em qualquer época da vida (pelo menos por cinco anos)
4.3 Coleta do material
Os pacientes do grupo doente foram submetidos a biópsia incisional utilizando-se para esse fim um punch número 3 (diâmetro aproximado de 3 mm). O material colhido foi acondicionado em formol a 10% para realização do exame histopatológico com coloração em hematoxilina e eosina (HE)
4.4 Critérios adotados para a interpretação das lâminas histológicas
Os aspectos histológicos das QAC foram interpretados seguindo a classificação de displasia epitelial de Van Der Waal (1986), que analisa e enumera os seguintes achados histológicos: 1- relação núcleo citoplasma aumentada, 2 – polaridade nuclear alterada, 3 – hiperplasia das células basais, 4 – núcleos hipercromáticos, 5 – mitoses anormais, 6 – maturação epitelial alterada, 7 – coesão celular reduzida, 8 – queratinização alterada, 9 – nucléolos aumentados24. A análise da graduação da atipia foi baseada no trabalho de Bánóczy e Csiba (1976) e oficializada pela World Health Organization (WHO, 1978) que classificaram como leve, quando dois achados histológicos estavam presentes; moderada, quando três ou quatro desses achados histológicos eram notados e, severa, quando cinco ou mais achados histológicos estavam presentes25,26. Outros aspectos histológicos estão presentes nos casos de QAC, como: degeneração do colágeno (elastose), infiltrado inflamatório, vasodilatação, acantose e atrofia, mas estas características não são levadas em consideração por Van Der Waal (1986) em sua classificação24.
4.5 Análise estatística
Para avaliar se o hábito de fumar e o consumo de álcool poderiam ser fatores de risco para a doença, foram utilizadas técnicas de regressão logística, para isso foram estimadas odds ratios (OR) e seus respectivos intervalos de confiança (IC) (com coeficiente de confiança de 95%). Inicialmente foi realizada uma análise univariada, ou seja, foi avaliada a contribuição individual de cada fator para explicar a presença da doença, sem levar em conta os demais fatores ou outras variáveis de confusão. Uma vez que nenhum dos fatores estudados foi significante para explicar a presença de doença, nenhum tipo de análise multivariada foi realizado.
Considerando apenas os pacientes com a doença, desejou-se avaliar se a idade, o tempo de doença e os fatores clínicos estavam associados com o grau de atipia da doença. Uma vez que poucos pacientes apresentaram um grau de atipia severo, decidiu-se agrupar as categorias “moderado” e “severo”, a fim de aumentar o número de pacientes em cada categoria, além de possibilitar o uso de modelos de regressão logística, que são relativamente simples de ajustar e oferecem resultados de fácil interpretação. Assim, a variável resposta nos modelos foi o grau de atipia (discreto ou moderado/severo). As variáveis explicativas foram a idade, o tempo de doença e os fatores clínicos. A idade e o tempo de doença foram categorizadas com o objetivo de facilitar a interpretação dos resultados. Optou-se por utilizar 3 faixas etárias, estabelecidas de modo a acomodar mais ou menos o mesmo número de pacientes em cada faixa. Para a variável tempo de doença, procurou-se gerar categorias de tal forma que houvesse pelo menos um paciente com atipia moderada ou severa em cada categoria. Inicialmente, foi realizada a análise univariada, onde foi calculado o número e a porcentagem de pacientes que apresentaram atipia moderada ou severa nas categorias de cada uma das variáveis explicativas. Para cada variável explicativa foi ajustado um modelo de regressão logística univariada, a partir do qual obtivemos a estimativa da odds ratio e do seu respectivo intervalo de confiança (com coeficiente de confiança de 95%).
A seguir, foi realizada a análise de regressão logística múltipla. Dado o grande número de variáveis explicativas, decidimos utilizar o método stepwise forward 27. As variáveis explicativas foram introduzidas uma a uma no modelo, da mais importante para a menos importante. A ordem de “importância” das variáveis foi definida segundo o logaritmo da verossimilhança do modelo univariado (quanto menor o valor de “–2 x logaritmo da verossimilhança”, mais importante a variável em questão). A cada passo desta abordagem, uma nova variável era introduzida ou retirada do modelo. Utilizamos como critérios para decidir se uma determinada variável deveria permanecer ou não no modelo o fato de o seu coeficiente ser significante ou marginalmente significante (nível descritivo do teste de Wald = 0.10). Após estas análises, foram testadas todas as interações possíveis entre essas variáveis que permaneceram no modelo, duas a duas, permanecendo apenas as que foram significantes. Após esse procedimento, foi definido o modelo final e estimados os seus parâmetros.
5 RESULTADOS
5.1 Aspectos epidemiológicos
Na avaliação da ficha clínica dos pacientes envolvidos na pesquisa, observamos que dos 29 pacientes com queilite actínica crônica, 19 são homens e 10 são mulheres. Com o objetivo de parear o nosso grupo controle, incluímos para o estudo também 29 pacientes, sendo também 19 homens e 10 mulheres, com média etária semelhante ao do grupo com QAC.
No quadro 1, verificamos os resultados epidemiológicos da nossa pesquisa.
| QAC | Lábio Normal | |
| Raça branca | 100% | 100% |
| homens | 19 | 19 |
| mulheres | 10 | 10 |
| Idade média | 56,14 anos | 55,21 anos |
| Fumantes | 48,28% | 34,48% |
| Não fumantes | 51,72% | 65,52% |
| Etilistas | 10,34% | 3,44% |
| Não etilistas | 89,66% | 96,56% |
| Fumantes e etilistas | 10,34% | 3,44% |
Quadro 1 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal
O quadro 2 contém algumas medidas descritivas para as variáveis de pareamento.
| QAC | Lábio Normal | |
| Raça branca | n=29 (100%) | n=29 (100%) |
| Homens | n=19 (66%) | n=19 (65%) |
| Mulheres | n=10 (34%) | n=10 (34%) |
| Idade | média = 56,14 anos | média = 55,21 anos |
| mínimo = 43 anos máximo = 72 anos | mínimo = 52 anos máximo = 60 anos |
Quadro 2 – Medidas descritivas para as variáveis de pareamento
O quadro 3 analisa a presença da QAC com relação ao fumo e ao álcool
N |
QAC |
% de QAC |
OR |
IC (OR, 95%) |
p |
|
|
Fumo |
||||||
|
não |
34 |
15 |
44 |
|||
|
sim |
24 |
14 |
58 |
1,77 |
0,54 a 5,85 |
0,29 |
|
Álcool |
||||||
|
não |
54 |
26 |
48 |
|||
|
sim |
4 |
3 |
75 |
3,23 |
0,24 a 175,53 |
0,30 |
Quadro 3 – Análise univariada (variável resposta – QAC: presente ou ausente)
Os resultados no quadro 3 sugerem que indivíduos que fumam têm mais chance de ter QAC do que indivíduo que não fumam, entretanto, este resultado não é estatisticamente significante. A chance de ter a doença entre os pacientes que fumam é 1,77 vezes a chance daqueles que não fumam (quase o dobro), entretanto o intervalo de confiança para a odds ratio contém o valor 1 (IC = 0,54 a 5,85; p=0,29). Analogamente, a chance dos indivíduos que consomem álcool terem a doença é 3.23 vezes a chance dos que não consomem, mas este resultado não é estatisticamente significante (p=0.30)
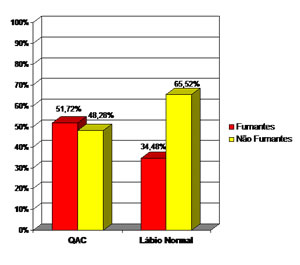
Figura 1 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal em relação ao tabagismo
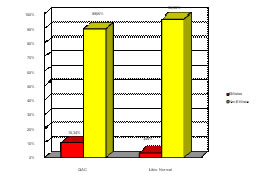
Figura 2 – Aspectos epidemiológicos dos pacientes portadores de QAC e com lábio normal em relação ao etilismo
5.2 Aspectos clínicos
Todos os pacientes com QAC foram avaliados clinicamente e analisados criteriosamente os seguintes sinais e sintomas clínicos: ressecamento, descamação, fissuras, adelgaçamento do vermelhão, eritemas, edema, sangramento, áreas leucoplásicas, alteração na linha de transição entre vermelhão e pele, crostas, perda da elasticidade labial (elastose), sintomatologia (dor, ardências etc) e ulcerações.
Os seguintes resultados foram observados (Figura 3):
– Ressecamento – 29 casos (100% dos casos)
– Alteração na linha de transição – 27 casos (93,10% dos casos)
– Descamação – 23 casos (79,31% dos casos)
– Eritemas – 23 casos (79,31% dos casos)
– Adelgaçamento do vermelhão – 22 casos (75,86% dos casos)
– Áreas leucoplásicas – 18 casos (62,06% dos casos)
– Fissuras – 16 casos (55,17% dos casos)
– Elastose labial – 16 casos (55,17% dos casos)
– Crostas – 9 casos (31,03% dos casos)
– Ulcerações – 7 casos (24,13% dos casos)
– Edema – 3 casos (10,34% dos casos)
– Sintomatologia – 2 casos (6,89% dos casos)
– Sangramento – 1 caso (3,44% dos casos)
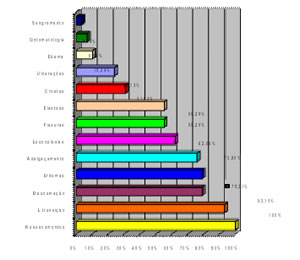
Figura 3 – Aspectos clínicos encontrados nos pacientes com QAC
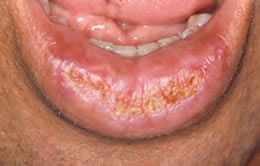
Caso clinico
Figura 4 – Exemplo de QAC de nosso estudo (caso 22) demonstrando ressecamento labial,alteração na linha de transição entre vermelhão e pele, edema e elastose labial, crostas, áreas eritematosas, ulceração, adelgaçamento do vermelhão e algumas áreas leucoplásicas
5.3 Aspectos histológicos
Todas as lâminas histológicas foram analisadas e confirmados os diagnósticos de QAC, sendo estes resultados classificados como QAC discreta, moderada e severa, na dependência dos níveis de atipia epitelial encontrados.
Dos 29 casos biopsiados, encontramos os seguintes resultados (Figura 5):
– 14 casos de QAC com atipia epitelial discreta (48,27% dos casos)
– 10 casos de QAC com atipia epitelial moderada (34,49% dos casos)
– 5 casos de QAC com atipia epitelial severa (17,24% dos casos)

Figura 5 – Graus de atipia celular observados nos 29 casos de QAC
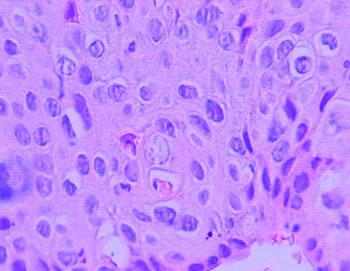
Figura 6 – Exemplo de QAC (aspecto histológico) de nosso estudo com atipia severa (caso 22), verificamos, relação núcleo citoplasma aumentada, núcleos hipercromáticos, maturação epitelial alterada (pleomorfismo da camada espinhosa), polaridade celular alterada, cromatina com distribuição irregular e nucléolos aumentados (aumento de 400 x)
5.4 Análise estatística dos resultados (clínicos, histológicos e epidemiológicos)
Confeccionamos uma tabela para estudo relacionando idade, duração da lesão, sexo, hábito de fumar, características clínicas com os graus de atipia (apresentados na avaliação histológica dos nossos casos) (Tabela 1).
| Atipia moderada ou severa | |||||||||||||||
| N | n | % | OR | IC(OR, 95%) | -2logλ | Ordem | |||||||||
| Idade (anos) | |||||||||||||||
| 43 a 52 | 10 | 5 | 50.0 | 1.0 | |||||||||||
| 53 a 59 | 9 | 7 | 77.8 | 3.5 | 0.5 a 25.9 | ||||||||||
| 60 a 72 | 10 | 3 | 30.0 | 0.4 | 0.1 a 2.7 | 36.6 | 7 | ||||||||
| Duração (anos) | |||||||||||||||
| 5 ou menos | 14 | 3 | 21.4 | 1.0 | |||||||||||
| 6 a 10 | 10 | 7 | 70.0 | 8.6 | * | 1.3 a 54.9 | |||||||||
| mais de 10 | 5 | 5 | 100.0 | 5.9E+09 | 0.0 a + ∞. | 26.8 | — | ||||||||
| Duração (anos) | |||||||||||||||
| 5 ou menos | 14 | 3 | 21.4 | ||||||||||||
| mais de 5 | 15 | 12 | 80.0 | 14.667 | ** | 2.4 a 88.5 | 29.6 | 2 | |||||||
| Sexo | |||||||||||||||
| homens | 19 | 12 | 63.2 | 1.0 | |||||||||||
| mulheres | 10 | 3 | 30.0 | 0.3 | 0.0 a 1.3 | 37.2 | 8 | ||||||||
| Hábito de fumar | |||||||||||||||
| não | 15 | 5 | 33.3 | 1.0 | |||||||||||
| sim | 14 | 10 | 71.4 | 5.0 | * | 1.0 a 24.3 | 35.8 | 6 | |||||||
| Álcool | |||||||||||||||
| não | 26 | 12 | 46.2 | 1.0 | |||||||||||
| sim | 3 | 3 | 100.0 | 1.9E+09 | 0.0 + ∞. | 35.9 | — | ||||||||
| Alt.linha trans. | |||||||||||||||
| não | 2 | 1 | 50.0 | 1.0 | |||||||||||
| sim | 27 | 14 | 51.9 | 1.1 | 0.1 a 19.0 | 40.2 | 13 | ||||||||
| Descamação | |||||||||||||||
| não | 6 | 2 | 33.3 | 1.0 | |||||||||||
| sim | 23 | 13 | 56.5 | 2.6 | 0.4 a 17.2 | 39.1 | 9 | ||||||||
| Eritema | |||||||||||||||
| não | 6 | 2 | 33.3 | 1.0 | |||||||||||
| sim | 23 | 13 | 56.5 | 2.6 | 0.4 a 17.2 | 39.1 | 10 | ||||||||
| Adelgaçamento | |||||||||||||||
| não | 7 | 1 | 14.3 | 1.0 | |||||||||||
| sim | 22 | 14 | 63.6 | 10.5 | * | 1.1 a 103.5 | 34.6 | 5 | |||||||
| Atipia moderada ou severa | |||||||||||||||
| N | n | % | OR | IC(OR, 95%) | -2log | Ordem | |||||||||
| Leucoplasia | |||||||||||||||
| não | 11 | 1 | 9.1 | 1.0 | |||||||||||
| sim | 18 | 14 | 77.8 | 35.0 | ** | 3.4 a 362.2 | 25.8 | 1 | |||||||
| Fissuras | |||||||||||||||
| não | 13 | 10 | 76.9 | 1.0 | |||||||||||
| sim | 16 | 5 | 31.3 | 0.1 | * | 0.0 a 0.7 | 33.9 | 4 | |||||||
| Elastose | |||||||||||||||
| não | 13 | 3 | 23.1 | 1.0 | |||||||||||
| sim | 16 | 12 | 75.0 | 10.0 | ** | 1.8 a 55.6 | 32.0 | 3 | |||||||
| Crosta | |||||||||||||||
| não | 22 | 8 | 36.4 | 1.0 | |||||||||||
| sim | 7 | 7 | 100.0 | 0.7 | 0.1 a 3.2 | 39.9 | 11 | ||||||||
| Ulceração | |||||||||||||||
| não | 22 | 8 | 36.4 | 1.0 | |||||||||||
| sim | 7 | 7 | 100.0 | 2.8E+09 | 0.0 a + ∞ | 28.8 | — | ||||||||
| Edema | |||||||||||||||
| não | 26 | 12 | 46.2 | 1.0 | |||||||||||
| sim | 3 | 3 | 100.0 | 1.9E+09 | 0.0 a + ∞. | 35.9 | — | ||||||||
| Sintomatologia | |||||||||||||||
| não | 27 | 14 | 51.9 | 1.0 | |||||||||||
| sim | 2 | 1 | 50.0 | 0.9 | 0.1 a 16.4 | 40.2 | 12 | ||||||||
| Sangramento | |||||||||||||||
| não | 28 | 15 | 53.6 | 1.0 | |||||||||||
| sim | 1 | 0 | 0.0 | 0.0 | 0.0 + ∞ | 38.7 | — | ||||||||
* p<0.05 **p<0.01
Tabela 1 – Análise univariada (variável resposta – Grau de Atipia: discreto ou moderado/severo)
A tabela 1 apresenta os resultados da análise univariada. A variável resposta nos modelos foi o grau de atipia (discreto ou moderado/severo). As variáveis explicativas foram a faixa etária, o tempo de doença e os fatores clínicos. O grau de atipia não parece estar associado com a faixa etária, o sexo, a presença de alteração na linha de transição entre pele e vermelhão, descamação, eritema, crosta e sintomatologia. As variáveis álcool, ulceração e edema parecem estar associadas ao grau de atipia, já que os todos pacientes com a presença de algumas dessas características apresentam atipia modedada/severa. Entretanto, o número de pacientes nessas circunstâncias é muito pequeno (3, 7 e 3), o que não permite a estimação de intervalos de confiança robustos para a odds ratio. Em geral, os intervalos variam de 0 até infinito, impossibilitando maiores conclusões. É possível que um estudo com mais pacientes possa confirmar a sugestão de que álcool, ulceração e edema são características muito relacionadas as atipias histológicas mais graves. Na análise das variáveis duração da doença, hábito de fumar, adelgaçamento, leucoplasias, fissuras e elastose verificamos que estas mostram-se realmente associadas ao grau de displasias epiteliais. Em geral, pacientes com a presença dessas características (exceto fissuras) parecem apresentar maior chance de ter atipia moderada/grave do que pacientes sem essas características. Já para a variável fissuras ocorre o oposto, isto é, pacientes com fissuras parecem ter menos chance de ter atipia moderada/grave do que pacientes com essa característica. Para avaliar a contribuição de cada variável para o grau de atipia, controlando para a presença das demais variáveis, ajustamos modelos de regressão logística múltipla, utilizando um método stepwise forward. As variáveis foram inseridas uma a uma, da menos importante para a mais importante. A tabela 2 apresenta as estimativas da odds ratio para os 6 primeiros modelos de regressão logística múltipla.
|
Variável |
Modelo |
|||||
|
explicativa |
1 |
2 |
3 |
4 |
5 |
6 |
|
Leucoplasia |
||||||
|
não |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
|
sim |
35.0** |
19.6** |
12.6* |
17.1* |
16.6** |
12.4* |
|
Duração (anos) |
||||||
|
5 ou menos |
1.0 |
1.0 |
1.0 |
1.0 |
1.0 |
|
|
mais de 5 |
7.1* |
7.2* |
5.6 |
5.5 |
11.2* |
|
|
Elastose |
||||||
|
não |
1.0 |
|||||
|
sim |
3.4 |
|||||
|
Fissuras |
||||||
|
não |
1.0 |
|||||
|
sim |
0.4 |
|||||
|
Adelgaçamento |
||||||
|
não |
1.0 |
|||||
|
sim |
2.6 |
|||||
|
Hábito de fumar |
||||||
|
não |
1.0 |
|||||
|
sim |
5.9 |
|||||
* p<0.05 **p<0.01
Tabela 2 – Odds ratio estimadas para os 6 primeiros modelos de regressão logística múltipla, através do método stepwise forward
No passo 1 inserimos a variável leucoplasia, que foi estatisticamente significativa (p<0.05) e permaneceu no modelo. No passo 2 acrescentamos a variável duração da doença. Esta variável foi marginalmente significativa (p<0.10) e por isto também permaneceu no modelo. Note que a estimativa da OR da variável leucoplasia diminuiu do modelo 1 para o modelo 2, sugerindo que uma parte do efeito da variável leucoplasia observado no modelo 1 era devido, de fato, ao tempo de doença. No passo 3 acrescentamos a variável elastose, entretanto esta variável não foi significativa e não permaneceu no modelo. Nos passos seguintes inserimos as demais variáveis, mas nenhuma delas permaneceu no modelo. Assim, dentre as variáveis estudadas, “leucoplasia” e “duração da doença” são suficientes para explicar o grau de atipia. A tabela 3 apresenta as estimativas do modelo final (modelo 2), que contém apenas as variáveis leucoplasia e duração da doença. Segundo esse modelo, pacientes com leucoplasia têm mais chance de ter atipia moderada/severa do que pacientes sem leucoplasia. Analogamente, pacientes com mais de 5 anos de doença têm mais chance de ter atipia moderada/severa do que pacientes com 5 anos de doença ou menos.
|
Variável explicativa |
OR |
IC(OR, 95%) |
p-valor |
|
Leuco |
|||
|
não |
|||
|
sim |
19.6 |
1.7 a 233.0 |
.02 |
|
Duração (anos) |
|||
|
5 ou menos |
|||
|
mais de 5 |
7.1 |
0.9 a 59.1 |
.07 |
Tabela 3 – Estimativas do modelo final de regressão logística
Finalmente, é extremamente importante ressaltar que conclusões sobre estas análises devem ser interpretadas com cautela. Devemos considerar que os resultados da análise de regressão logística múltipla poderiam ter sido diferentes se os modelos tivessem contemplado as variáveis álcool, ulceração e edema (que foram excluídas devido ao pequeno número de pacientes). Além disso, nota-se que não fizemos grandes afirmações sobre a força das associações ou a magnitude do efeito de cada variável sobre o grau de atipia (representado pelo valor da odds ratio), mas apenas sobre a presença ou ausência de associação, determinado pelo fato de a odds ratio ser significantemente maior do que 1, do ponto de vista estatístico. Isto ocorreu porque o evento sob estudo (presença de tipia moderada/severa) é um evento freqüente entre pacientes com QAC. Lembramos que a odds ratio pode ser utilizada como estimativa da magnitude do risco de ocorrência do evento apenas quando trata-se de um evento raro. Entretanto, os modelos fornecem estimativas confiáveis sobre a presença ou ausência de associação.
6 DISCUSSÃO
A QAC é considerada uma lesão cancerizável e tem como agente etiológico bem definido a radiação solar1. Dardanoni (1984), consideraram as características étnicas de pele clara um dos mais poderosos fatores de risco para a QAC e o câncer de lábio28. Em nosso trabalho, verificamos que 100% dos pacientes com QAC eram da raça branca. Recentes trabalhos descrevem a prevalência da QAC como acometendo principalmente pacientes acima da quinta década de vida8, estes dados foram confirmados em nossa pesquisa, pois observamos uma média de idade em nossos pacientes portadores de QAC de 56,14 anos. Inúmeros trabalhos científicos no decorrer dos anos, descrevem as formas clínicas e histológicas da QAC, mas nenhum deles apresentou esses dados de forma percentual13,15,29
Aguiar (1995) foi a primeira a analisar alguns aspectos clínicos da QAC de forma mais detalhada30. Em seu estudo foram avaliados 69 pacientes com QAC chegando aos seguintes resultados: eritema em 71,01% (em nosso estudo encontramos 79,31%), descamação em 69,56% (em nosso estudo 79,31%), ulceração em 15,94% (em nosso estudo 24,13%), infiltração ou elastose em 40,57% (em nosso estudo 55,17%), crosta em 13,04% (em nosso estudo 31,03%), atrofia ou adelgaçamento do vermelhão em 71,01% (em nosso estudo 75,86%), áreas leucoplásicas em 37,68% (em nosso estudo 62,06%), alteração na linha de transição entre pele e vermelhão em 88,40% (em nosso estudo 93,10%). Percebemos que de maneira geral, em nossos pacientes as alterações clínicas encontradas foram mais freqüentes. Em recente trabalho, Cavalcanti (2008) analisou também 29 pacientes com QAC verificando os graus de atipias celulares encontradas, todos os casos apresentaram atipia epitelial nas seguintes proporções: atipia moderada em 10,35%, atipia moderada em 27,59% e atipia severa em 62,06% dos casos11. Interessante compararmos estes resultados, pois eles são absolutamente antagônicos aos de nosso estudo, pois em nossos pacientes encontramos 48,27% de atipias discretas, 34,49% de atipias moderadas e 17,24% de atipias severas. Esta variação pode ser justificada quando avaliamos o perfil dos pacientes do trabalho de Cavalcanti (2008), pois na sua grande maioria eram pacientes lavradores que trabalham por períodos prolongados e por vários anos sob a ação maléfica dos raios solares11. Já em nosso estudo, o padrão de atividades profissionais de nossos pacientes é mais variado e até mesmo pelo fato dos participantes da pesquisa residirem em áreas urbanas. Em nosso estudo, fizemos uma avaliação estatística detalhada, correlacionando os aspectos clínicos da QAC e o hábito de fumar e beber com a incidência de atipias moderadas e severas. Na análise dos resultados, o grau de atipia não se mostrou associado a faixa etária, ao sexo, a presença de alteração na linha de transição, descamação, eritema, crosta e sintomatologia. Como já foi comentado no capítulo de resultados, as variáveis álcool. ulceração e edema parecem estar associadas ao grau de atipia, pois todos os pacientes com a presença dessas características apresentam atipia moderada/severa. Entretanto, o número de pacientes com estas características é muito pequeno (3, 7 e 3 respectivamente), o que não permitiu conclusões estatisticamente significativas para que o hábito de consumir bebida alcoólica, a presença de ulceração e edema estivessem associados ao grau de atipia. Também foi citado no capítulo anterior que as variáveis: duração da doença, hábito de fumar, adelgaçamento de vermelhão, leucoplasias, elastose e fissuras, mostraram-se associadas ao grau de displasias epiteliais. Em geral, pacientes com a presença dessas características (exceto fissuras) parecem apresentar maior chance de ter atipia moderada/severa do que pacientes sem essas características. Já para a variável fissuras ocorreu o oposto, isto é, pacientes com fissuras parecem ter menos chance de ter atipia moderada/severa do que pacientes com essa característica.
As variáveis duração da lesão e leucoplasia foram as únicas que estatisticamente podem ser consideradas como conclusivamente associadas ao grau de displasia epitelial. É importante ressaltar que em nos nossos casos que foram classificados como atipia epitelial severa no resultado das biópsias, os pacientes foram submetidos a vermelhectomia e nos casos de atipia moderada e discreta os pacientes foram orientados para controles periódicos em nosso ambulatório.
Sem dúvida, a QAC está relacionada ao câncer de lábio e ambos relacionados diretamente à exposição solar embora a literatura também descreva o fumo como um fator a ser considerado1,7,15. Esta correlação foi também percebida em nossos resultados, pois encontramos 48,28% de fumantes com QAC enquanto que pacientes com lábio normal, 34,48% tinham o hábito de fumar, apesar desta diferença, em nossa análise estatística estes valores não podem ser considerados conclusivos.
Lindqvist, Teppo e Pukkala (1981) concluíram em seu estudo na Finlândia que a baixa de resistência da semi-mucosa labial causada pelo trabalho ao ar livre e o consumo de bebida alcoólica levam a um aumento na susceptibilidade aos agentes carcinogênicos do tabaco21. Em nosso estudo foi verificada uma tendência maior ao aparecimento da QAC em pacientes etilistas muito embora como o número dos etilistas foi pequeno tanto no grupo doente (3 pacientes) como no grupo controle (1 paciente), este resultado não foi estatisticamente significante.
7 CONCLUSÕES
Os resultados obtidos por meio das metodologias por nós utilizadas, nos permitem concluir que:
– A QAC ocorreu em 100% nos indivíduos da raça branca, mais no gênero masculino (19 homens e 10 mulheres) e na idade média de 56,14 anos.
– Dos aspectos clínicos da QAC analisados, o ressecamento labial foi o único que se mostrou presente em 100% dos casos.
– Pacientes com QAC que apresentam clinicamente áreas leucoplásicas tem estatisticamente mais chance de apresentar atipias epiteliais moderadas e severas.
– O fumo isoladamente como também a sua associação com o álcool não foram estatisticamente significantes na contribuição para o aparecimento da QAC.
– Os aspectos histológicos da QAC mostram que das 29 lâminas analisadas, encontramos atipia discreta em 14 casos, moderada em 10 e severa em 5.
– Pacientes com QAC por mais de 5 anos têm estatisticamente mais chance de apresentar atipias epiteliais moderadas e severas.
REFERÊNCIAS
1. Pacca FOT, Cerri A, Silva CEXSR, Silva SS. Queilite actínica: relato de caso clínico e tratamento com ácido tricloroacético. Rev Bras Cir Cabeça Pesc 1999;23(3):103-6.
2. de Freitas Mda C; Ramalho LM; Xavier FC; Moreira AL; Reis SR. p53 and MDM2 protein expression in actinic cheilitis.J Appl Oral Sci;16(6):414-9, 2008 Nov-Dec.
3. Gomes AP; Johann JE; Lovato GG; Ferreira AM Comparative analysis of the mast cell density in normal oral mucosa, actinic cheilitis and lip squamous cell carcinoma. Braz Dent Journal;19(3):186-9, 2008.
4. Chou A; Dekker N; Jordan RC. Identification of novel fibroblast growth factor receptor 3 gene mutations in actinic cheilitis and squamous cell carcinoma of the lip. Oral Surg Oral Med Oral Pathol Oral Radiol Endod;107(4):535-41, 2009 Apr..
5. Dufresne RG; Cruz AP; Zeikus P; Perlis C; Jellinek NJ. Dermabrasion for actinic cheiliti. Dermatol Surg;34(6):848-50, 2008 Jun
6. Dufresne Jr. RG, Curlin MU. Actinic cheilits: a treatment review. Dermatol Surg 1997;23(1):15-21.
7. Douglas CW, Gammon MD. Reassessing the epidemiology of lip cancer. Oral Surg Oral Med Oral Pathol 1984;57(6):631-42.
8. Markopoulos A, Albanidou-Farmaki E, Kayavis I. Actinic cheilitis: clinical and pathologic characteristics in 65 cases. Oral Dis 2004;10(4):212-6.
9. Schwartz RA, Stoll HL. Epithelial precancerous lesions. In: Fitzpatrick TB, Eisen AZ, Wolff K, Freedberg IM, Austen KF. Dermatology in general medicine. 4.ed. New York: McGraw-Hill; 1993.
10. Ayres Jr. S. Chronic actinic cheilitis. J Am Med Assoc 1923;81(14):1183-5.
11. Cavalcante AS; Anbinder AL; Carvalho YRActinic cheilitis: clinical and histological features. J Oral Maxillofac Surg;66(3):498-503, 2008 Mar
12. Nicolau SG, Balus L. Chronic cheilitis and cancer of the lower lip. Br J Dermatol 1964;76(2): 278-89.
13. Cataldo E, Doku C. Solar cheilitis. J Dermatol Surg Oncol 1981;7(12): 989-995.
14. Koopmann Jr. CF, Coulthard SW. The oral cavity and aging. Otolaryngol Clin North Am 1982;15(2):293-312.
15. Stanley RJ, Roenigk RK. Actinic cheilitis: treatment with the carbon dioxide laser. Mayo Clin Proc 1988;63(3):230-5.
16. Huber MA, Terezhalmy GT. The patient with actinic cheilosis. Gen Dent 2006;54(4):274-82.
17. Scully C. Oral precancer: preventive and medical approaches to management. Oral Oncol 1995;31(1):16-26.
18. Brasil. Ministério da Saúde. Coordenadoria de Programas de Controle do Câncer (Pro – Onco). Câncer de boca. Rio de Janeiro: INCA; 2001.
19. Brennan JA, Boyle JO, Kock WM. Association between cigarette smoking and mutation of the p 53 gene in squamous – cell carcinoma of the head and neck. N Engl J Med 1995;332(11):712-27.
20. Winn DM. Diet and nutricion in the etiology of oral câncer. Am J Clin Nutr 1995;61(2):4375-455.
21. Lindqvist C, Teppo L, Pukkala E. Occupations with low risk of lip cancer show high risk cancer of the head. Community Dent Oral Epidemiol 1981;9:247-50.
22. Garewal HS. Response of oral leukoplakia to betacaroteno. J Clin Oncol 1993;8(10):1715-20.
23. Aguilar LT, Antunes JLF, Lehn CN, Marcucci G.Prótese, higiene, escolaridade e renda no risco do carcinoma epidermóide bucal: estudo caso-controle. Rev Assoc Paul Cir Dent. 2006;60(1): 25-8
24. Van Der Waal S. Diagnostic and therapeutic problems of oral precancerous lesions. Int J Oral Maxillofac Surg 1986;15:790-8.
25. Bánóczy J, Csiba A. Occurrence of epitelial dysplasia in oral leucoplakia: analysis and follow – up study of 12 cases. Oral Surg Oral Med Oral Pathol 1976;42(6):766-74.
26. WHO. Colaborating Centre for Oral Precancerous Lesions. Definition of leucoplakia and related lesions; an aid to studies on oral precancer. Oral Surg 1978;46(4):518-39.
27. Hosmer Jr DW, Lemeshow S. Applied logistic regression. New York: John Wiley & Sons; 1989.
28. Dardanoni L. A case-control study on lip câncer risk factors in Ragusa (Sicily). Int J Cancer 1984;34(3):335-7.
29. Kaugars GE. Actinic cheilits: a review of 152 cases. Oral Surg. Oral Med. Oral Pathol Oral Radiol Endod 1999;88(2):181-6.
